-
MEXICO
North America
South America
Europe
- Belgium (FR)
- Belgium (NL)
- Denmark
- Deutschland
- Europe
- España
- France
- Ireland
- Italia
- Nederland
- Norge
- Polska
- Россия
- Suomi
- Sverige
- United Kingdom
- Schweiz (FR)
- Schweiz (CH)
- Türkiye
Middle East / Africa
Asia / Pacific
Le sorprenderá cómo el diseño innovador de las agujas para plumas puede ayudar a los pacientes a la hora de administrarse insulina1-2
La técnica de inyección de insulina varía, por lo que los pacientes pueden llegar a inyectarse de manera incorrecta3*
Aunque haga todo lo posible por enseñar a los pacientes la técnica de inyección adecuada, se ha demostrado que la mayoría de los pacientes se inyectan la insulina utilizando técnicas muy diversas que pueden afectar a la correcta administración de la insulina.3*
“Una de las cosas que siempre me preocupan es cómo sé que una vez que me lo inyecto en el cuerpo está en el lugar correcto o que realmente funciona.”†
Cita de un paciente extraída de un estudio de mercado
Ayude a sus pacientes a mejorar la técnica de inyección para que sea más cómoda y segura1-2
Las agujas para plumas BD Ultra-FineTM tienen características innovadoras que han demostrado proporcionar una experiencia de inyección más fácil y cómoda, y la confianza de que se ha administrado correctamente la dosis completa de insulina.1-2§‡
Precisión con una aguja más corta
Una aguja de insulina debe ser lo suficientemente larga para atravesar la piel, pero lo suficientemente corta para no llegar al músculo, ya que se ha demostrado que las inyecciones intramusculares provocan más dolor y aumentan el riesgo de hipoglucemia.4
Las agujas para plumas BD Ultra-FineTM ayudan a reducir el riesgo de inyección intramuscular en comparación con las agujas de 6 mm y de mayor longitud.5¶

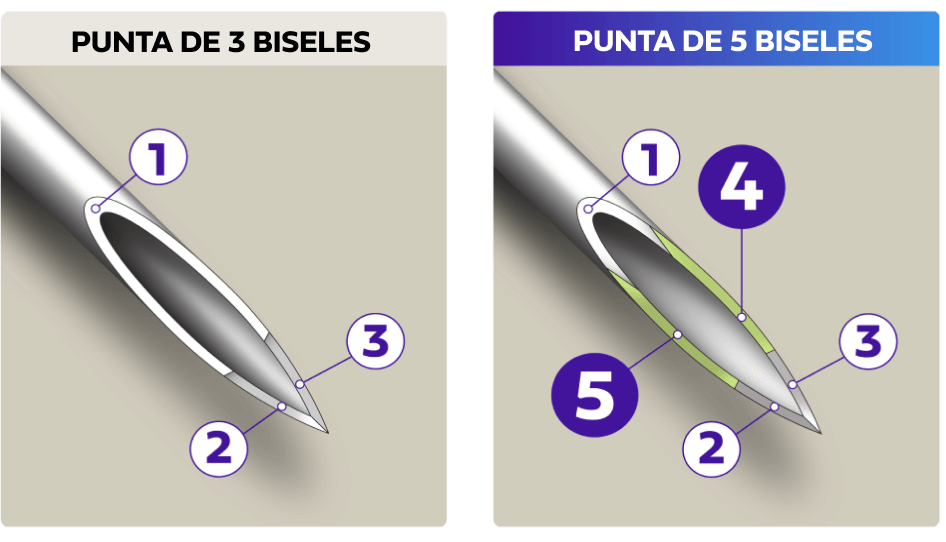
Comodidad con una punta de 5 biseles
Una punta de aguja de 5 biseles está diseñada para una inyección más cómoda con menos dolor de inyección percibido en comparación con las agujas para pluma de 3 biseles estudiadas.2§


Las agujas para plumas BD Ultra-FineTM son compatibles con los inyectores para plumas más utilizados. Aunque cambie la terapia de inyección, sus pacientes con diabetes pueden seguir utilizando las agujas BD Ultra-FineTM.7||
CONSULTE NUESTRA TABLA DE COMPATIBILIDAD
Descubra recursos que podrían ayudar a sus pacientes a alcanzar sus objetivos de tratamiento
CENTRO DE RECURSOS EMBECTA*N=230 pacientes con diabetes encuestados como parte de un estudio transversal observacional de comportamiento en Canadá.
†Cita de un paciente extraída de un estudio de mercado, agosto de 2022.
‡Se incluyeron 198 pacientes con diabetes en este estudio prospectivo, multicéntrico, aleatorizado, abierto, cruzado, de 2 periodos, para evaluar las diferencias en la fuerza percibida del pulgar y en la confianza de que se administraba la dosis completa de insulina, entre la aguja para pluma (PN) habitual de los participantes y la aguja para pluma de pared extrafina (XTW) correspondiente. Se observaron diferencias significativas a favor de las agujas para plumas XTW respecto a la fuerza ejercida con el pulgar y la confianza con la que se administró la dosis completa en 28,4 mm (IC del 95 %, 23,7 - 33,2) y 24,4 mm (IC del 95 %, 19,7 - 29,1), respectivamente; (todos, p <0,001).
§86 pacientes con diabetes utilizados para evaluar las diferencias entre las puntas de las agujas para pluma de 5 biseles y las de 3 biseles en agujas para plumas (PN) de igual longitud y calibre. La PN de 5 biseles se consideraría más cómoda si el límite inferior del 95 % para el porcentaje de inserciones fuera mayor que el límite superior del 95 %. Tras informar a los sujetos, la PN de 5 biseles fue seleccionada con mayor frecuencia que la de 3 biseles por su mayor comodidad (p = 0,01) en el uso doméstico. Cuando los pacientes no conocían los diseños de bisel de la PN, no se encontraron diferencias respecto a la facilidad de inserción (37,1 %, 36,8 %) y la comodidad (37,1 %, 37,6 %).
¶El riesgo de IM se estimó en función de la inserción a 90 o 45 grados. La profundidad entre la superficie de la piel y el músculo se midió mediante ultrasonido. No se aplicaron inyecciones propiamente dichas.
#La pared ultrafina se introdujo como norma ISO para el diámetro de la pared interior en 2016.
||Consulte el prospecto del fabricante que acompaña al dispositivo de pluma. Esta lista no incluye todas las plumas compatibles.
Referencias
1. Aronson R, Gibney MA, Oza K, et al. Insulin pen needles: effects of extra-thin wall needle technology on preference, confidence, and other patient ratings. Clin Ther. 2013;35(7):923-933.
2. Hirsch L, Gibney M, Berube J, Manocchio J. Impact of a modified needle tip geometry on penetration force as well as acceptability, preference, and perceived pain in subjects with diabetes. J Diabetes Sci Technol. 2012;6(2):328-335.
3. Bari B, Corbeil MA, Farooqui H, et al. Insulin injection practices in a population of Canadians with diabetes: an observational study. Diabetes Ther.2020;11(11):2595-2609.
4. Frid AH, Kreugel G, Grassi G, et al. New insulin delivery recommendations. Mayo Clinic Proc. 2016;91(9):1231-1255.
5. Gibney MA, Arce CH, Byron KJ, Hirsch LJ. Skin and subcutaneous adipose layer thickness in adults with diabetes at sites used for insulin injections: implications for needle length recommendations. Curr Med Res Opin. 2010;26:1519-30.
6. 6. Stainless steel needle tubing for the manufacture of medical devices --requirements and test methods. ISO 9626. 2016.
7.Pen Needle Compatibility Status Summary with Diabetes Care & Non-Diabetes Drug Delivery Devices. Document Number: 149OTH-0004-20 Rev Y – 2025-11-18.
8. Fingertip Formulary, as of 05/16/2023.
|
Compatible with widely used pen injection devices1* |
|
|---|---|
|
Lilly |
KwikPen (Abasaglar, Basaglar, Humalog, Humalog Mix, Humulin, Lyumjev, Mounjaro/Zepbound, Rezvoglar), Forteo, Tempo Pen |
|
Novo Nordisk |
FlexPen (Novolin, NovoLog, NovoMix, NovoRapid), FlexTouch (Fiasp, Levemir, Tresiba), Ozempic, Saxenda, Victoza, Wegovy, Xultophy |
|
Sanofi |
SoloStar (Admelog, Apidra, Lantus, Toujeo), Lyxumia, Soliqua, AllSTAR, JuniorSTAR |
|
AstraZeneca |
Byetta, SymlinPen |
|
Merck |
Aluetta (Saizen) |
|
Organon |
Puregon Pen |
|
Sandoz |
Omnitrope 10 Pen, SurePal |
|
Viatris |
Semglee |
|
*Listed brands are owned by third parties. Reference: 1. Pen Needle Compatibility Status Summary with Diabetes Care & Non-Diabetes Drug Delivery Devices. Document Number: 149OTH-0004-20 Rev Y – 2025-11-18. |
|